Old Browser
Overview
BD FACSChorus™ソフトウェアは、手動のセットアップやモニタリング不要の効率化されたワークフローにより、シンプルなソーティングが可能になるため、お客様は科学研究に集中できます。'
スループットを向上し、ダウンタイムを最小限に抑え、実験の成功を後押しする高度自動化技術を用いることにより、セルソーティングプロセス全体をガイドします。
Features
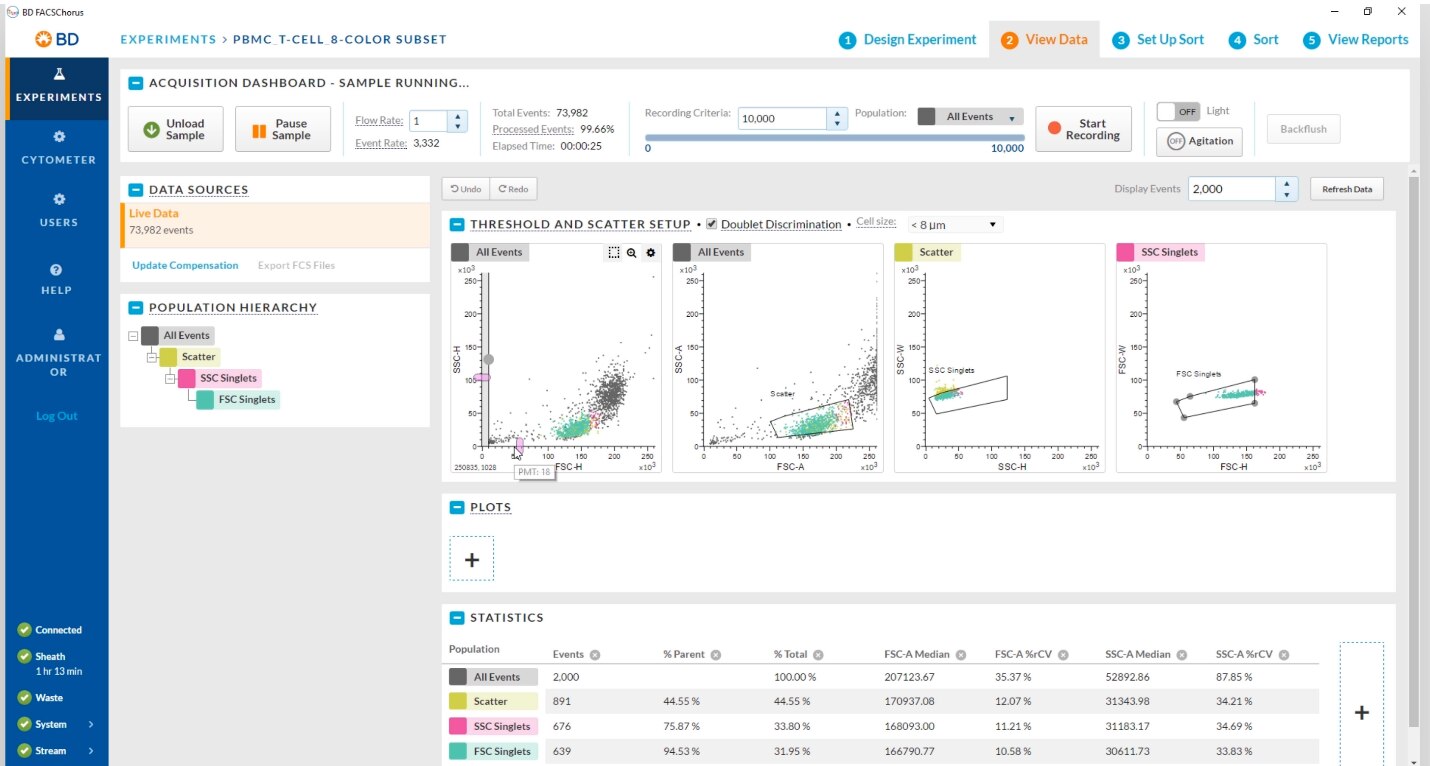
BD FACSChorus™ソフトウェアは、直感的で使いやすい設計になっているので、初めての方でもすぐにソーティングができるようになります。

特長:
- Laser Delay、Drop Delay、およびサイドストリームの自動セットアップ
- ワークフロー全体にわたりユーザーを導くインターフェイス
- 画面上の指示
- インデックスソーティングによるデータ取得および解析
- 初期設定のプロットおよびソートゲート
- チューブオーバーフローの予防
- オペレーターの安全を守るために、Drop Delay設定の際やソーティング作業を開始する際など、必要な場合にのみディフレクションプレートに電圧がかかります
- FCS3.1対応
- 実績のあるBD FACS™AccudropテクノロジーとBD®SweetSpotテクノロジー
Applications
HEK-293細胞を0.25μgのpAcGFP(Clontech)ベクターでトランスフェクトし、GFPの発現を解析しました。さまざまなレベルでGFPを発現している細胞が明確に分離できました。死細胞を除去するためにDAPIを使用しました。GFPの発現レベルが低い細胞と高い細胞をゲートし、purityモードで1,000イベント/秒でソーティングをおこないました。ソーティング後の解析により、どちらの細胞集団も99%以上の純度でソーティングされたことが示されました。

HEK-293細胞を70%エタノールで固定し、0.5μg/ mLのDAPIで染色しました。
(A)Population Hierarchy : 側方散乱光(SSC)、前方散乱光(FSC)、DAPIのArea、Height, Widthパラメーターはダブレットと凝集の除去に使用しました。この実験におけるゲーティングストラテジーは、有糸分裂中の細胞の一部また大部分を除去して表示している可能性があります。像を過小評価または除外している可能性があります。
(B)DNA含有量解析: DAPIシングレットゲート内の細胞は、2Nから4NのDNA含有量の変化を示しており、4N以上のダブレットや凝集が取り除かれていることが確認できました。
(C)ソートされたシングルセルの確認: DAPIシングレットゲート内の細胞は、3枚の96マルチウェルプレートに99.7%の確率でソートされました。顕微鏡観察により1ウェルに1細胞がソートされたことを確認しました。写真は1細胞がウェルにソーティングされた様子を示しています。

健康なドナーから末梢血単核細胞を単離し、Tregサブセットの検出と精製のために表面マーカー(CD3、CD4、CD25、CD127、CD45RA)のカクテルで染色しました。リンパ球とシングレット分画を最初にゲートし、続いてCD3+CD4+ T細胞のゲーティングをおこないました(データ未掲載)。TregはCD127low/negCD25highとして特定できました。Tregゲートから、CD45RA+ ナイーブおよびCD45RA– メモリーTregを特定し、purityモードで5,000イベント/秒でソートしました。ソート後の再解析により、メモリーとナイーブTregの集団が明らかになりました。次に、イムノフェノタイピングのため、精製した細胞を表面マーカー(CD31、CD39、およびCD15)で染色しました。高度に活性化したTregはCD45RA– メモリーTreg内で検出されたのに対して、CD31+recent thymic emigrants (RTEs)はCD45RA+ナイーブTreg内で検出されました。

BALB/cマウスの脾臓を機械的に細切し、コラゲナーゼによる酵素消化によって脾細胞を単離しました。
(A)BD IMag™ Mouse Dendritic Cell Enrichment Setを用いてバルクで分離することで、MHC II+CD11chigh conventional dendritic cellsのCD8α+ およびCD8α– サブセットをそれぞれ35倍および29倍に濃縮しました。
(B)バルクでの分取後、purityモードを用いてCD8α+ およびCD8α– サブセットを1,000イベント/秒でソーティングしました。ソート後の再解析の結果、両サブセットの純度はいずれも99%以上でした。

-
BD FACSChorus™ FC Bead Lot Updater
-
Brochure
-
Quick Reference Guide
For Research Use Only. Not for use in diagnostic or therapeutic procedures.
Report a Site Issue
This form is intended to help us improve our website experience. For other support, please visit our Contact Us page.